El descubrimiento proporciona un nuevo objetivo para los tratamientos contra la malaria.
QUÉ:
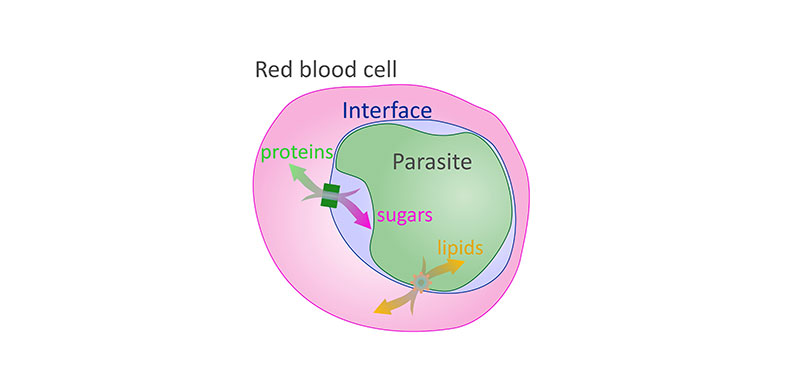
Los investigadores de los Institutos Nacionales de la Salud y de otras instituciones han descubierto otro conjunto de orificios o canales en forma de poros, que atraviesan el saco unido a la membrana que encierra al parásito de la malaria más mortal mientras infecta a los glóbulos rojos. Los canales permiten el transporte de lípidos (moléculas parecidas a la grasa) entre la célula sanguínea y el parásito Plasmodium falciparum. El parásito extrae los lípidos de la célula para preservar su crecimiento y también puede secretar otros tipos de lípidos para apropiarse de las funciones celulares y satisfacer sus necesidades.
El hallazgo se produce después del descubrimiento anterior de otro conjunto de canales a través de la membrana que permite el flujo bidireccional de las proteínas y los nutrientes no grasos entre el parásito y los glóbulos rojos. Juntos, los descubrimientos plantean la posibilidad de tratamientos que bloqueen el flujo de nutrientes para matar de hambre al parásito.
El equipo de investigación fue dirigido por Joshua Zimmerberg, M.D., Ph.D., investigador principal en la sección de Biofísica Integrativa del Instituto Nacional de Salud Infantil y Desarrollo Humano (NICHD) Eunice Kennedy Shriver de los NIH. El estudio aparece en Nature Communications.
En 2018, hubo 228 millones de casos de malaria en todo el mundo, lo que provocó más de 400 000 muertes, el 67 % de las cuales se produjeron en niños menores de 5 años, según la Organización Mundial de la Salud. En el estudio actual, los investigadores determinaron que los canales a través del saco o vacuola que encierra al parásito están hechos de proteína relacionada con Niemann-Pick C1 (PfNCR1). Los canales de PfNCR1 están restringidos a lugares donde la membrana de la vacuola toca la membrana del parásito. Los canales que el equipo descubrió en el estudio anterior están formados por la proteína exportada 2 (EXP2). Las áreas de la membrana de la vacuola que contienen EXP2 se ubican lejos de la membrana del parásito, a una distancia promedio de 20 a 40 nanómetros. Los investigadores creen que el parásito puede utilizar esta variación a la distancia para separar los dos sistemas de transporte.
QUIÉN:
Joshua Zimmerberg, M.D., Ph.D., de la sección de Biofísica Integrativa del NICHD está disponible para comentarios en inglés.
ARTÍCULO:
Garten et al. Contacting domains segregate a lipid transporter from a solute transporter in the malarial host-parasite interface. Nature Communications. 2020.
###
Acerca del Instituto Nacional de Salud Infantil y Desarrollo Humano Eunice Kennedy Shriver (NICHD): El NICHD lidera la investigación y la capacitación para comprender el desarrollo humano, mejorar la salud reproductiva, mejorar la vida de niños y adolescentes, y optimizar las habilidades para todos. Si desea más información, visite https://espanol.nichd.nih.gov.
Acerca de los Institutos Nacionales de la Salud (NIH): NIH, la agencia de investigación médica de los EE. UU., incluye 27 institutos y centros, y es un componente del Departamento de Salud y Servicios Humanos de los EE. UU. NIH es la principal agencia federal que realiza y apoya investigaciones médicas básicas, clínicas y traslacionales, y que investiga las causas, los tratamientos y las curas para enfermedades comunes y raras. Para obtener más información sobre los NIH y sus programas, visite https://salud.nih.gov.

 ARRIBA
ARRIBA